一、单项选择(本大题共11题,每题2分,共22分)
1.下列变化属于化学变化的是
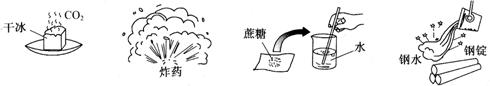
A B C D
2.下列实验操作正确的是
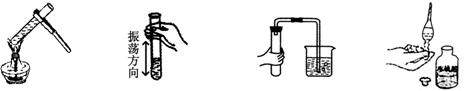
A.加热液体 B.振荡试管 C.检查气密性 D.取用液体
3.2012年4月15日,央视曝光了一些企业生产的药用胶囊里重金属铬(Cr)超标,即“毒 胶囊”事件。已知铬原子核内有24个质子,铬元素的相对原子质量为52。有关铬原子的说法不正确的是
A.铬原子呈电中性 B.铬原子核内中子数为 28
28
C.铬原子核外电子数为24 D.铬原子核电荷数为28
4.白钨矿主要成分是CaWO4,则CaWO4中钨元素(W)的化合价是
A.+6 B.-6 C.+2 D.-2
5.我市许多地方的水硬度很高,日常生活中为了降低水的硬度,常采用的方法是
A.加肥皂水 B. 煮沸 C.蒸馏 D.过滤
煮沸 C.蒸馏 D.过滤
6.某反应的微观示意图如图所示,其 中“●”表示汞原子,“○”表示氧原子,下列说法正确的是
中“●”表示汞原子,“○”表示氧原子,下列说法正确的是
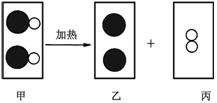
A.图中甲、乙、丙三种物质中,甲、丙属于氧化物
B.图中甲、乙、丙三种物质均是由分子构成的
C.该反应前后分子种类、原子种类均没有改变
D.图中甲、乙、丙三种物质中既有单质又有化合物
7.请你根据所学化学知识判断,下列说法正确的是
A.天然气泄漏,开灯检查泄漏处
B.汽油除去油污和洗涤剂除去油污都是乳化过程,与食醋除水垢的原理不同
C.铵态氮肥不可与碱性物质混合施用
D.KNO3和Ca3(PO4)2都是复合肥料,为植物生长提供N、P、K等营养元素
8.按酸、碱、盐、氧化物的顺序排列的一组物质是
A.H2SO4 NH3·H2O Na2CO3 CO2
B.HCl CaO NaHCO3 CO
C.SO3 Ba(OH)2 NaCl H2O2
D.HNO3 C2H5OH NH4Cl H2O
9.下列实验方案中,能达到实验目的的是
选项 | 实 验 目 的 | 实 验 方 案 |
A | 检验二氧化碳气体中含有少量一氧化碳 | 将混合气体依次通过灼热的氧化铁和澄清石灰水,观察澄清石灰水的变化 |
B | 除去BaCl2溶液中的Ba(OH)2溶液 | 加入适量的稀硫酸,过滤 |
C | 除去氯化钠固体中的少量碳酸钠 | 加入适量稀盐酸,充分反应后蒸发 |
D | 分离碳酸钠和氢氧化钠的混合物 | 加入过量的氢氧化钙溶液,过滤 |
10.向AgNO3溶液中加入一定量的Zn和Fe混合物粉末,充分反应后过滤,得到滤渣和浅绿色滤液。关于该滤渣和滤液有下列说法:
① 向滤渣中加入稀盐酸,一定有气泡产生;② 向滤液中加入稀盐酸,一定有沉淀产生;③ 滤渣中一定含有Ag;④ 滤液中一定含有Fe(NO3)2,一定不含有AgNO3,可能含有Zn(NO3)2。以上说法正确的共有
A.0个 B.1个 C.2个 D.3个
11. 下列各组物质的水溶液,只用组内两两物质间的反应,不用其它试剂,不能将其一一
区别的是
A.NaCl Na2CO3 Ca(NO3)2 HCl
B.CuSO4 NaOH H2SO4 Ba(OH)2
C.K2CO3 H2SO4 HNO3 BaCl2
D.Na2SO4 BaCl2 K2CO3 KNO3
二、填空与简答(本大题共8题,每空1分,共27分)
12.用化学用语填空:
(1)两个氮原子___________; (2)氯化亚铁中的阳离子___________;
(3)氧化镁中镁元素显+2价___________;
(4)地壳中含量最多的金属元素和最多的非金属元素组成的化合物为___________。
13.a、b、c 三种物质的溶解度曲线如图一所示,请回答下列问题:
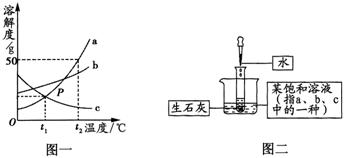
(1)t1℃时,a、b、c的溶解度由大到小的顺序是___________。(用“>”或“<”或“=”表示)
(2)t2℃时,将30g的a物质放入50mL(水的密度约为1g/cm3)水中不断搅拌,所得溶液的质量为___________g。
(3)图二中,试管里预先装有少量生石灰,当试管里加入适量水时,反应放出的热量使烧杯中某饱和溶液析出固体(不考虑水分蒸发)。请判断:该饱和溶液中溶质是___________。(填“a”或“b”或“c”)
14.PM2.5是指大气中直径小于或等于2.5微米的颗粒物,主要来自于化石燃料的燃烧和扬尘,对人体健康和空气质量影响很大。
(1)机动车尾气检测,其中包括对PM2.5的检测。汽油燃烧产生的颗粒物主要是___________(写名称),这是汽油___________燃烧产生的。
(2)下列有关PM2.5的说法错误的是___________。(填涂序号)
A.PM2.5专用口罩中使用了活性炭,是利用了活性炭的吸附性
B.PM2.5的颗粒大小与分子大小差不多
C.PM2.5是造成灰霾天气的“元凶”之一
D.点燃烟花爆竹会产生PM2.5
15.生活中处处有化学。请你用化学知识回答问题:
(1)为改善学生营养状况,增强学生体质,我国很多地方都启动了“蛋奶工程”,则牛奶、鸡蛋中富含的营养素为___________。
(2)关注健康,预防疾病,下列叙述正确的是___________。(填涂序号)
A.缺铁会引起缺铁性贫血
B.缺碘会引起甲状腺肿大,俗称“大脖子病”
C.成年人缺钙会发生骨质软化或疏松
D.缺钠会影响小孩生长发育,智力低下
(3)下列生活中的物品所使用的主要材料,属于有机合成材料的是 ___________。(填涂序号)

A.塑料盆 B.钛合金镜架 C.木筷 D.全棉布袋
16.钢铁是使用最多的金属材料。
(1)生铁和钢都是铁的合金,其中含碳量较高的是___________ 。
(2)人们大量使用的 是铁合金而不是纯铁,这是因为铁的合金具有更多优良性能,例如钢比纯铁硬度___________。(填“大”或“小”)
是铁合金而不是纯铁,这是因为铁的合金具有更多优良性能,例如钢比纯铁硬度___________。(填“大”或“小”)
17.A、B、C、D、E分别是稀硫酸、澄清石灰水、碳酸钠溶液、氧化铜和二氧化碳气体中的一种。用五个圆表示这五种物质,用两圆相切表示两种物质可以发生反应,“→”表示物质间的转化关系(部分反应物、生成物和反应条件已略去)。请回答下列问题:
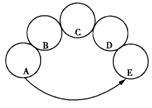
(1)根据物质间的反应及转化关系,A是__________。(写化学式)
(2)C与D反应的实验现象为_________。
(3)D与E反应的化学方程式为_________。
18.在金属活动顺序表里,金属的位置越靠前,它的活动性就越强,在化学反 应中越容易失去电子。
应中越容易失去电子。
(1)Ca、Mg、K三种金属在化学反应中失去电子的能力由强到弱的顺序是_________。
(2)Ca、Mg、K三种金属的原子结构示意图如右图所示,请根据这三种金属的原子结构示意图,结合已学过的有关原子结构的知识推测:金属单质失去电子能力的强弱主要与哪些因素有关?_________。(任答一点)
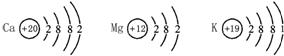
(3)能证明Cu的活动性比Ag强的方法是 _________。(用化学方程式表示)
(4)非金属单质也具有类似金属与盐溶液之间的置换反应规律,即活动性较强的非金属可把活动性较弱的非金属从其盐溶液中置换出来。例如,在溶液中可发生如下反应:Cl2+2NaBr== 2NaCl+Br2 Br2+2KI== 2KBr+I2↓ I2+Na2S== 2NaI+S
由此判断,硫(S)、溴(Br2)、碘 (I2)、氯气(Cl2)四种非金属单质的活动性由弱到强的顺序是_________。
(I2)、氯气(Cl2)四种非金属单质的活动性由弱到强的顺序是_________。
19.常见的食品脱氧剂多为无机铁系脱氧剂,其主要成分为活性铁粉。某同学自制了脱氧剂(2g铁粉、0.5g活性炭、0.5g食盐),并用该脱氧剂进行如下两个实验:
实验Ⅰ:
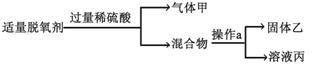
请回答:操作a的名称是 _________,溶液丙中含有的溶质是 _________。(写化学式)
实验Ⅱ:将乙烘干后进行如下实验,物质之间的转化关系如下图(部分产物略去)。
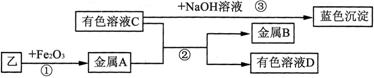
(1)反应②属于基本反应类型中的_________反应。
(2) 向溶液C中加入Ba(NO3)2溶液,有白色沉淀产生,其化学方程式为_________。
(3)区别溶液C与溶液D的物理方法是_________。
三、实验与探究(本大题共2题,每空 1分,共14分)
1分,共14分)
20.下面是初中常见的实验,请结合所学化学知识,回答有关问题:
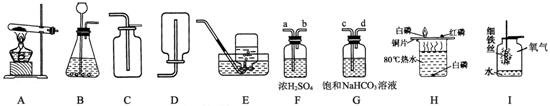
(1)实验室用高锰酸钾制氧气,装置A中有一处错误,请加以改正________,写出反应的化学方程式 ________;若用C装置收集氧气,写出验满的方法(包括操作、现象、结论)______________________。
(2)实验室制取二氧化碳的化学方程式为________________ ,常用的发生装置和收集装置是________________。(填序号)
(3)实验室制得的二氧化碳气体中常含有少量HCl和水蒸气,为了制得纯净、干燥的二氧化碳气体,除杂装置的导管按气流方向连接顺序是________。(填涂序号)
A.a→b→c→d B.b→a→c→d
C.c→d→a→b D.d→c→b→a
(4)许多实验中都用到水,图H、I中水的作用分别是H:________I:________。
21.以下是2013年我市实验操作的考查内容,请回答有关问题。
【实验目的】证明酸和碱发生了中和反应。
【演示实验】将一定量的稀盐酸加入到盛有NaOH溶液的小烧杯中。
【实验原理】该反应的化学方程式为 ________________。
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中的溶质是什么呢?
【猜想与假设】甲组同学的猜想如下:
猜想一:只有NaCl 猜想二:有NaCl和HCl
猜想三:有NaCl和NaOH 猜想四:有NaCl、HCl和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的。这个不合理的猜想应该是________。
【实验探究】
(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴酚酞试液,无明显变化,溶液中一定没有________。
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、AgNO3溶液、Na2CO3溶液,进行如下三个方案的探究。
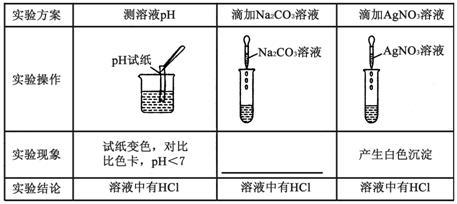
【得出结论】通过探究全班同学一致确定猜想二是正确的。
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定。同时指出【实验探究】(2)中存在两处明显错误,请大家反思。同学们经过反思发现了这两处错误:
(1)“实验操作”中的错误是________。
(2)“实验方案”中也有一个错误的,错误的原因是 ________。
四、计算(本大题共2题,第22题2分,第23题5分,共7分)
22.低钠盐适合患有高血压、肾病、心脏病的患者服用,苹果酸钠盐(C4H5O5Na)是低钠盐的一种。请回答:
(1)苹果酸钠盐的组成元素是____________。(写名称)
(2)苹果酸钠盐的相对分子质量是____________。
23.某化工厂的纯碱样品中含有少量的氯化钠。化学兴趣小组的同学为测定该纯碱样品中碳酸钠的含量,取该纯碱样品11g,全部溶解在80g水中,再加入170.7g 氯化钡溶液,恰好完全反应,过滤,得到19.7g沉淀(不考虑过滤过程中物质质量的损失)。请计算:
氯化钡溶液,恰好完全反应,过滤,得到19.7g沉淀(不考虑过滤过程中物质质量的损失)。请计算:
(1)纯碱样品中碳酸钠的质量。
(2)反应后所得溶液中溶质质量分数。
2013年鄂尔多斯市初中毕业升学考试
化学参考答案及评分标准
一、单项选择(本大题共11题,每题2分,共22分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
答案 | B | C | D | A | B | D | C | A | C | B | D |
二、填空与简答(本大题共8题,每空1分,共27分)
12.(1)2N (2)Fe2+ (3)MgO (4)Al2O3
13.(1) b > a = c (或b > c = a)  (2)75 (3)c
(2)75 (3)c
14.(1)炭(错别字不得分) 不完全 (2)B
15.(1)蛋白质 (2)A、B、C (3)A
16.(1)生铁 (2)大
17.(1)CuO (写名称不得分) (2)有白色沉淀产生
(3)Ca(OH)2 + CO2 = CaCO3↓+ H2O
18.(1)K Ca Mg (或K > Ca > Mg)
(2)最外层电子数(或电子层数) (3)Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
(4) S 、I2 、 Br2 、 Cl2 (或S<I2< Br2<Cl2或硫、碘、溴、氯气)
19.实验Ⅰ:过滤 FeSO4 、NaCl、 H2SO4 (写名称,错答、漏答均不得分)
实验Ⅱ:(1)置换 (2)CuSO4 + Ba(NO3) 2= BaSO4 ↓+ Cu(NO3) 2
( 3)观察溶液颜色,蓝色为CuSO4溶液,浅绿色为FeSO4溶液。
3)观察溶液颜色,蓝色为CuSO4溶液,浅绿色为FeSO4溶液。
(其它合理答案均可)
三、实验与探究(本大题共2题,每空1分,共14分)
20.(1)在试管口放一团棉花 2KMnO4 = K2MnO4 + MnO2 + O2 ↑
将带火星的木条放在集气瓶口,木条复燃,证明氧气已收集满
(2)CaCO3+2HCl =CaCl2 +H2O +CO2↑ B、C(错选、漏选均不得分)
(3)C
(4)H:提供热量,隔绝空气(只答一项不得分) I:防止生成物炸裂瓶底
21.【实验原理】 HCl + NaOH = NaCl + H2O
【猜想与假设】 猜想四(或四)
【实验探究】 (1)NaOH或氢氧化钠
(2)实验现象:有气泡产生
【评价反思】
(1)将pH试纸浸入溶液中(其它合理答案均可)
(2)NaCl与AgNO3反应也会产生白色沉淀,不能证明溶液中一定有HCl存在。(其它合理答案均可)
四、计算(本大题共2题,第22题2分,第23题5分,共7分)
22.(1)碳、氢、氧、钠(1分) (2)156(1分)
23.解法一:
解:设Na2CO3的质量为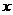 ,生成NaCl的质量为
,生成NaCl的质量为
 Na2CO3+ BaCl2 = BaCO3↓+ 2NaCl
Na2CO3+ BaCl2 = BaCO3↓+ 2NaCl
106 197 117 ……(1分)
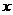 19.7g
19.7g 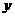
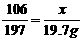
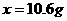 ……(1分)
……(1分) 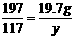
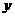 =11.7g ……(1分)
=11.7g ……(1分)
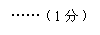
 反应后所得溶液中溶质的质量=11g-10.6g +11.7g = 12.1g
反应后所得溶液中溶质的质量=11g-10.6g +11.7g = 12.1g
| ……(1分) |
反应后所得溶液的质量=11g+80g+170.7g-19.7g =242g
反应后所得溶液中溶质质量分数= 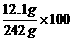 %=5%
%=5%
答:纯碱样品中碳酸钠的质量为10.6g,反应后所得溶液中溶质质量分数为5%。
解法二:
解:设Na2C O3的质量为
O3的质量为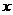 ,BaCl2的质量为
,BaCl2的质量为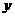 ,生成NaCl的质量为z
,生成NaCl的质量为z
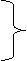 Na2CO3+ BaCl2 = BaCO3↓+ 2NaCl
Na2CO3+ BaCl2 = BaCO3↓+ 2NaCl
106 208 197 117 ……(1分)
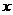
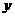 19.7g z
19.7g z
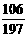 =
=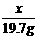
 = 10.6g ……(1分)
= 10.6g ……(1分)
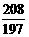 =
=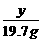
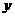 = 20.8g
= 20.8g
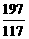 =
= 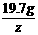 z = 11.7g
z = 11.7g

 反应后所得溶液中溶质的质量=11g-10.6g+11.7g=12.1g
反应后所得溶液中溶质的质量=11g-10.6g+11.7g=12.1g
反应后所得溶液的质量=80g+170.7g-20.8g+12.1g=242g
反应后所得溶液中溶质质量分数=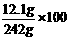 %=5% ……(1分)
%=5% ……(1分)
答:纯碱样品中碳酸钠的质量为10.6g,反应后所得溶液中溶质质量分数为5%。
(其它合理解法均可得分)












