第Ⅱ卷 非选择题(38分)
二、填空题(本大题5个小题,共25分)
17、(5分)写出下列物质的化学式:
(1)纯碱 ;(2)烧碱 ;(3)大理石的主要成分 ;
(4)地壳中含量最多的金属元素 ;(5)目前使用量最大的金属 。
18、(6分)根据下列要求填空:
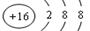
(1) 表示的是 (填离子符号),其核电荷数为 ;
(2)质量分数大于1﹪的盐酸溶液常温下pH 7(填“>”、“<”、“=”),向盛有盐酸的试管中滴入紫色石蕊试液,溶液变为 色;
(3)金属钛又称为21世纪金属,在各个领域都有重要用途。人造卫星和宇宙飞船上的天线是由钛镍形状记忆合金制造的。工业上生产钛是在高温下用熔融TiCl4与钠反应制得。请写出该反应的化学方程式 。
19、(6分)有一包白色粉末,可能含有BaCl2、Na2CO3、NH4NO3、NaCl中的部分或全部,为确定其组成,设计如下方案:
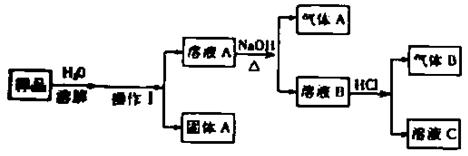
请回答下列问题:
(1)操作Ⅰ的名称是 ,需要使用的玻璃仪器有玻璃棒、烧杯和;
(2)气体A有刺激性气味,则气体A的化学式为;
(3)气体B为无色无味,则产生该气体的化学方程式为 ;
(4)通过上述实验,还不能确定的物质的化学式 。
20、(4分)已知98﹪浓H2SO4密度为1.84g/cm3,62﹪浓HNO3密度为1.14g/cm3;若要配制浓H2SO4与浓HNO3的混合溶液,则应将 (填化学式)沿玻璃棒缓慢倒入盛有
(填化学式)的烧杯中,边加边搅拌,冷却后装瓶。过程中玻璃棒的作用是、。
21、(4分)氯碱工业是重要的化学工业,采用电解精制的饱和食盐水来制取NaOH,
 2NaCl + 2H2O2NaOH + H2↑ + Cl2↑。但粗盐中含有杂质Na2SO4、MgCl2、CaCl2
2NaCl + 2H2O2NaOH + H2↑ + Cl2↑。但粗盐中含有杂质Na2SO4、MgCl2、CaCl2
、泥沙等,必须经过提纯才能使用。提纯中常用下列操作步骤:①用稍过量的NaOH除去MgCl2;②过滤;③用稍过量的BaCl2除去Na2SO4;④用稍过量的Na2CO3除去CaCl2等;⑤用稍过量的HCl除去NaOH、Na2CO3;
则:(1)正确的操作顺序为或(填步骤编号);
(2)加入Na2CO3溶液,其目的之一是除去CaCl2,还的一个目的,其反应的化学方程式为 。
三、实验探究题(本大题1个小题,共7分)
22、(7分)某天化学兴趣小组听老师讲:“浓硫酸加衣服等于洞洞眼眼,还有刺激性气味产生”。兴趣小组结合浓硫酸的性质思考,难道浓硫酸能与碳单质反应?若反应,会生成什么呢?
[查阅资料]:
①SO2能使澄清石灰水变浑浊 Ca(OH)2 + SO2 = CaSO3 + H2O ;
②SO2能使品红溶液褪色,用于检验SO2存在;
③SO2能与溴水反应而被吸收 SO2 + Br2 + 2H2O = H2SO4 + 2HBr 。
[提出猜想]:
从物质组成元素看,可能生成H2、CO2、CO、SO2气体及H2O;
[实验步骤]:
实验小组设计了如下步骤:
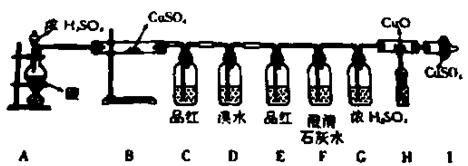
(1)按上述图示安装好仪器; (2)检查气密性;
(3)加入对应药品,并将浓H2SO4放入烧杯中; (4)加热A,加热H;
(5)停止加热。
[实验分析]:
(1)B处,固体由白色变蓝色,说明有H2O生成;
(2)C处,品红溶液褪色,说明有 (填化学式)生成;
(3)E处,品红溶液不褪色,说明 (填化学式)已被除尽;
(4)F处,澄清石灰水变浑浊,则产生浑浊的化学方程式为;
(5)H、I处无现象,说明无CO、H2生成。
[实验结论]:
(1)气体中有H2O和 生成,无CO、H2生成;
 (2)浓硫酸能与碳单质反应,其化学方程式为 。
(2)浓硫酸能与碳单质反应,其化学方程式为 。
四、计算题(本大题1个小题,共6分)
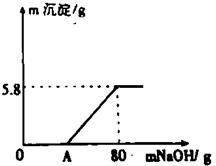
23、(6分)向100g稀H2SO4溶液中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入质量分数为20﹪的NaOH溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示。请回答:
(1)OA段无沉淀产生,请写出反应的化学方程式;
(2)加入镁粉的质量为 g;
(3)求产生氢气的质量是多少g?(写出计算过程,保留小数点后一位)。












