二、非选择题(共6小题,满分40分)
31.(5分)(2013•苏州)请用线段连接有对应关系的两行间的点(每个点只能连接一次).
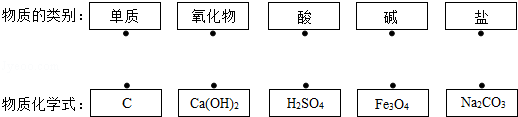
考点: 单质和化合物的判别;常见的氧化物、酸、碱和盐的判别.
专题: 物质的分类.
分析: 单质是由一种元素组成的纯净物,氧化物是由两种元素组成并且一种元素是氧元素的化合物;电离时生成的阳离子都是氢离子的化合物是酸;电离时生成的阴离子都是氢氧根离子的化合物是碱;由金属离子和酸根离子组成的化合物是盐,根据单质、氧化物、酸、碱、盐的特点分析.
解答: 解:碳是由一种元素组成的纯净物,属于单质;
氢氧化钙电离时电离出的阴离子全部是氢氧根离子,属于碱;
硫酸电离时电离出的阳离子全部是氢离子,属于酸;
四氧化三铁是由铁、氧两种元素组成的化合物,属于氧化物;
碳酸钠是由钠离子和碳酸根离子组成的化合物,属于盐.
故答案为: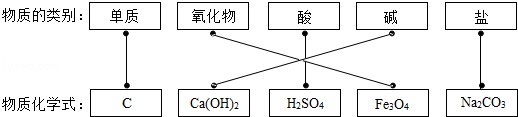
点评: 解答本题要掌握物质的分类方法方面的知识,只有这样才能对各种物质进行正确的分类.
32.(10分)(2013•苏州)完成下列变化的化学方程式,并按要求填空.
(1)镁条在氧气中燃烧: 2Mg+O2 2MgO ;其基本反应类型是: 化合反应 .
2MgO ;其基本反应类型是: 化合反应 .
(2)高温煅烧石灰石: CaCO3 CaO+CO2↑ ;其基本反应类型是: 分解反应 .
CaO+CO2↑ ;其基本反应类型是: 分解反应 .
(3)工业炼铁的主要原理是一氧化碳跟三氧化二铁在高温下反应: Fe2O3+3CO 2Fe+3CO2 ;该反应中气体的化学计量数之比为: 1:1 .
2Fe+3CO2 ;该反应中气体的化学计量数之比为: 1:1 .
(4)小苏打(NaHCO3)与盐酸的反应: NaHCO3+HCl=NaCl+H2O+CO2↑ ;小苏打的用途有 可用作发酵粉等 .
(5)将少量硫酸铵晶体与熟石灰混合研磨: (NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+2H2O ;研磨用的器皿是: 研钵 .
考点: 书写化学方程式、文字表达式、电离方程式;反应类型的判定.
专题: 化学用语和质量守恒定律.
分析: 首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤进行书写;再根据反应特征确定反应类型.
解答: 解:(1)镁条在氧气中燃烧生成氧化镁,反应的化学方程式为:2Mg+O2 2MgO;该反应符合“多变一”的特征,属于化合反应.
2MgO;该反应符合“多变一”的特征,属于化合反应.
(2)高温煅烧石灰石生成氧化钙和二氧化碳,反应的化学方程式为:CaCO3 CaO+CO2↑;该反应符合“一变多”的特征,属于分解反应.
CaO+CO2↑;该反应符合“一变多”的特征,属于分解反应.
(3)工业上用一氧化碳还原氧化铁炼铁,主要是利用CO的还原性,在高温下和氧化铁反应生成铁和二氧化碳,反应的化学方程式为Fe2O3+3CO 2Fe+3CO2;该反应中气体的化学计量数之比为3:3=1:1.
2Fe+3CO2;该反应中气体的化学计量数之比为3:3=1:1.
(4)小苏打是碳酸氢钠的俗称,碳酸氢钠和稀盐酸混合生成氯化钠、水和二氧化碳,反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑;小苏打还可以可用作发酵粉等.
(5)硫酸铵晶体与熟石灰混合研磨生成氨气、水和硫酸钙,反应的化学方程式为:(NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+2H2O;研磨用的器皿是研钵.
故答案为:(1)2Mg+O2 2MgO;化合反应;(2)CaCO3
2MgO;化合反应;(2)CaCO3 CaO+CO2↑;分解反应;(3)Fe2O3+3CO
CaO+CO2↑;分解反应;(3)Fe2O3+3CO 2Fe+3CO2;1:1;(4)NaHCO3+HCl=NaCl+H2O+CO2↑;可用作发酵粉;(5)(NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+2H2O;研钵.
2Fe+3CO2;1:1;(4)NaHCO3+HCl=NaCl+H2O+CO2↑;可用作发酵粉;(5)(NH4)2SO4+Ca(OH)2=CaSO4+2NH3↑+2H2O;研钵.
点评: 本题难度不大,考查学生根据反应原理书写化学方程式、判定反应类型的能力,掌握化学方程式的书写方法、四种基本反应类型的特征即可正确解答本题.
33.(5分)(2013•苏州)某食用盐是取自深埋地下千余米的岩盐为原料,用先进工艺精制而成.
(1)在实验室若将5.0g该岩盐溶解、过滤和 蒸发 等步骤,初步提纯后,得到4.0g精盐,其产率为: 80 %.
(2)每百克食用盐中还需添加亚铁氰化钾1mg,其作用是: 预防缺铁性贫血 .
(3)现有一批采用此岩盐精制所得的食用盐,其主要成分(按质量分数计)是氯化钠60.0%、氯化钾40.0%.请列式计算该批食用盐中钠元素质量分数比纯氯化钠中钠元素的质量分数低多少(计算结果精确到0.1%)?
考点: 氯化钠与粗盐提纯;元素的质量分数计算;人体的元素组成与元素对人体健康的重要作用.
专题: 常见的盐 化学肥料.
分析: (1)根据粗盐的提纯的步骤分析;
(2)根据元素与人体健康之间的关系分析;
(3)根据化学式进行有关的计算.
解答: 解:(1)若将5.0g该岩盐溶解、过滤和蒸发等步骤,初步提纯后,得到4.0g精盐,其产率为: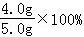 =80%;
=80%;
(2)向食用盐中添加亚铁氰化钾的作用是:预防缺铁性贫血;
(3)该批食用盐中钠元素质量分数比纯氯化钠中钠元素的质量分数低: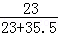 ×100%﹣
×100%﹣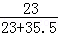 ×100%×60%=
×100%×60%=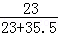 ×100%(1﹣60%)=15.7%.
×100%(1﹣60%)=15.7%.
故答为:(1)蒸发,80;(2)预防缺铁性贫血;(3)15.7%.
点评: 本题的难度不大,了解了粗盐提纯的步骤和根据化学式的计算即可解答.
34.(8分)(2013•苏州)今年我市初中化学实验考察的内容是“实验室制取二氧化碳气体”,请回答下列相关问题.
(1)下列有关连接仪器方法的叙述中,错误的是: C (填序号).
A.将单孔胶塞的约二分之一旋进试管口
B.乳胶管与玻璃导管连接前用水湿润管口
C.乳胶管一端塞进玻璃导管内
D.玻璃导管口一端旋进乳胶管一端
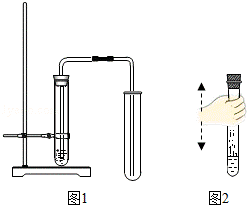
(2)①图1是某人设计的制备二氧化碳的示意图,其中有 3 处错误.
②写出实验室制备二氧化碳气体的化学方程式 CaCO3+2HCl═CaCl2+H2O+CO2 ↑
③“实验是检验化学原理的最高法庭”.下列有关实验室收集二氧化碳的叙述中,不符合实验事实的是: AD (填序号)
A.因为CO2能溶于水,一般不用排水法收集CO2
B.因为CO2溶解性并不强,与水反应生成碳酸又不稳定,可用排水法收集CO2
C.排水法收集CO2时,需观察倒置的试管内液面下降和有气泡从试管口逸出
D.通常状况下,CO2密度大于空气,只能用向上排空气法收集CO2
E.因为CO2是无色气体,排空气法收集CO2时,需用燃着的木条“验满”
(3)如图2所示,向集满CO2的试管内倒入约占试管容积三分之一的澄清石灰水,旋紧胶塞,上下持续震荡一段时间.
①请写出实验室鉴定CO2的化学方程式 CO2 +Ca(OH)2═CaCO3↓+H2O ;
②充分震荡后,试管内压强 < 试管内大气压强(选填“>”或“=”或“<”);
③震荡试管前,旋紧胶塞的目的 防止石灰水冲出试管腐蚀皮肤 、 促进石灰水充分吸收CO2 .
考点: 二氧化碳的实验室制法;仪器的装配或连接;二氧化碳的化学性质;书写化学方程式、文字表达式、电离方程式.
专题: 碳单质与含碳化合物的性质与用途;常见气体的实验室制法、检验、干燥与净化.
分析: (1)有关连接仪器方法的叙述中,错误的是:乳胶管一端塞进玻璃导管内,应该是玻璃导管口一端旋进乳胶管一端;
(2)图1是某人设计的制备二氧化碳的示意图,其中的错误有:导管伸入橡皮塞太长了,进入液体内,气体无法导出;铁夹应该夹在试管的中上部;收集气体的试管没有固定;制取装置包括加热和不需加热两种,实验室制取CO2,是在常温下,用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.有关实验室收集二氧化碳的叙述中,不符合实验事实的是:因为CO2能溶于水,一般不用排水法收集CO2;通常状况下,CO2密度大于空气,只能用向上排空气法收集CO2;实验证明二氧化碳溶解性并不强,与水反应生成碳酸又不稳定,可用排水法收集CO2.
(3)二氧化碳一般用澄清石灰水检验,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水;充分震荡后,试管内压强小于试管内大气压强,因为二氧化碳反应了;震荡试管前,旋紧胶塞的目的是:防止石灰水冲出试管腐蚀皮肤、促进石灰水充分吸收CO2 .
解答: 解:(1)有关连接仪器方法的叙述中,错误的是:乳胶管一端塞进玻璃导管内,应该是玻璃导管口一端旋进乳胶管一端;故答案为:C
(2)图1是某人设计的制备二氧化碳的示意图,其中的错误有:导管伸入橡皮塞太长了,进入液体内,气体无法导出;铁夹应该夹在试管的中上部;收集气体的试管没有固定;用碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,配平即可;有关实验室收集二氧化碳的叙述中,不符合实验事实的是:因为CO2能溶于水,一般不用排水法收集CO2;通常状况下,CO2密度大于空气,只能用向上排空气法收集CO2;实验证明二氧化碳溶解性并不强,与水反应生成碳酸又不稳定,可用排水法收集CO2;故答案为:①3;②CaCO3+2HCl═CaCl2+H2O+CO2 ↑;③AD(答全才给分,选错不给分)
(3)二氧化碳一般用澄清石灰水检验,二氧化碳和氢氧化钙反应生成碳酸钙白色沉淀和水;充分震荡后,试管内压强小于试管内大气压强,因为二氧化碳反应了;震荡试管前,旋紧胶塞的目的是:防止石灰水冲出试管腐蚀皮肤、促进石灰水充分吸收CO2 ;故答案为:①CO2 +Ca(OH)2═CaCO3↓+H2O;②<;③防止石灰水冲出试管腐蚀皮肤、促进石灰水充分吸收CO2
点评: 本考点主要考查了仪器的链接、气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,主要出现在实验题中.
35.(5分)(2013•苏州)用胶头滴管向盛有20.0g稀硝酸的烧杯中滴加2滴酚酞试液,再向其中缓缓加入20.0g5.6%的氢氧化钾溶液;边滴加边用玻璃棒搅拌,待滴入最后1滴碱液时,混合液刚好由无色变为粉红色,且30s颜色不变,即可认为恰好完全反应.
(1)请列式计算反应后溶液中溶质的质量分数.
(2)将反应后的溶液冷却到室温,若要配置室温时的饱和溶液,还需向其中加入10.0g硝酸钠固体.按规范操作,用托盘天平称取10.0g硝酸钾时,若指针略向左偏转,要使指针居中的恰当操作是: 用药匙从左盘取下少许硝酸钾固体
(3)根据上述情境,列式计算此时硝酸钾的溶解度(计算结果保留小数点后一位).
考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
专题: 溶质质量分数与化学方程式相结合的计算.
分析: (1)氢氧化钾和稀硝酸恰好完全反应,有氢氧化钾溶液的质量可以计算出氢氧化钾的质量:20.0g×5.6%=11.2g,然后结合方程式计算出生成的硝酸钾的质量,并结合溶质的质量分数计算解答;
(2)指针略向左偏转,说明添加的硝酸钾的质量偏多;
(3)据溶解度的概念结合硝酸钾溶液的质量、硝酸钾的质量分析解答.
解答: 解:(1)20.0g5.6%的氢氧化钾溶液中氢氧化钾的质量是:20.0g×5.6%=1.12g
设生成硝酸钾的质量为x
KOH+HNO3=KNO3+H2O
56 101
1.12g x
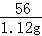 =
=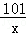
x=2.02g
反应后溶液中溶质的质量分数是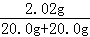 ×100%=5.05%
×100%=5.05%
(2)指针略向左偏转,说明添加的硝酸钾的质量偏多,要使天平平衡,可用药匙从左盘取下少许硝酸钾固体;
(3)溶解度是一定温度下,100g水中最多溶解物质的质量,设该温度下硝酸钾的溶解度为y,此时饱和溶液中硝酸钾的质量是2.02g+10.0g=12.02g,则水的质量是20.0g+20.0g﹣2.02g=37.98g,则有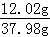 =
=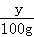 ,解得y≈31.6g;
,解得y≈31.6g;
故答案为:(1)反应后溶液中溶质的质量分数是5.05%;
(2)用药匙从左盘取下少许硝酸钾固体;
(3)此时硝酸钾的溶解度是31.6g.
点评: 了解方程式计算的方法,及溶解度的概念和相关计算、天平的使用,才能结合选项正确分析解答,要细心分析.
36.(7分)(2013•苏州)太湖水经苏州胥江水厂处理的大致流程如下.
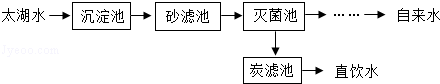
(1)从沉淀池中出来的水经过沙滤池的操作称为: 过滤 .经沙滤池后的水在灭菌池中被通入的臭氧(O3)进行杀菌处理,再经一系列后续处理成为自来水进入千家万户;在深度处理区,炭滤池中活性炭的作用是: 吸附水中的色素和异味
(2)有人做了如下的甲、乙2个实验.因在乙实验中得到一些有色沉淀,于是就说“自来水没有纯水好”.某校兴趣小组同学为验证上述说法的真伪,又增做了丙和丁2个对比试验(均在室温下)
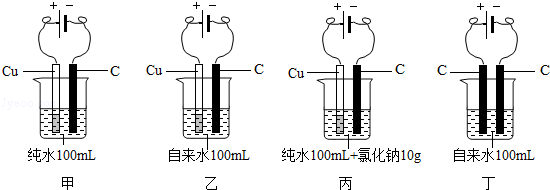
项目 | 甲 | 乙 | 丙 | 丁 |
与电源正极相连的电极附近区域 | 现象不明显 | 有小气泡产生,渐有有色沉淀生成,沉淀颜色逐渐加深 | 有刺激性气味的较多气泡产生,且有许多有色沉淀生成 | 有小气泡产生 |
与电源负极相连的电极附近区域 | 现象不明显 | 有小气泡产生 | 有较多气泡产生 | 有小气泡产生,渐有少量沉淀生成 |
①上述实验中能量转换的形式为: 电能→化学能 .
②由上述4个对比试验可知: 丙 装置(填序号)中水样的导电能力最强.在上述对比试验中,生成有色沉淀的主要原因是: 在通电情况下,铜电极与溶液中的某些离子发生了反应
(3)水厂的检测人员用浑浊度仪测出该厂自来水中颗粒物的量为0.55;用pH仪测出水质的 酸碱 度为7.66,此时水质呈弱 碱 性.这是因为自来水中含有了多种天然水溶解的对人体有益的微量元素的缘故.且在合格标准内.
考点: 自来水的生产过程与净化方法;过滤的原理、方法及其应用;溶液的酸碱度测定;电解水实验;物质发生化学变化时的能量变化.
专题: 空气与水.
分析: (1)沙滤池对水起过滤作用,活性炭具有吸附性,可吸附水中的色素和异味等;
(2)电解水的过程是将电能转化为化学能;由现象可知:丙与其他三个实验相比,现象更明显,水的导电能力最强;由乙和丙实验现象及所用电极推测原因;
(3)溶液的酸碱度常用pH表示,大于7的溶液显碱性,据此分析解答.
解答: 解:(1)沙滤池对水起过滤作用,活性炭具有吸附性,可吸附水中的色素和异味等;
(2)①电解水的过程是将电能转化为化学能;
②由现象可知:丙与其他三个实验相比,现象更明显,水的导电能力最强;乙和丙用的都是自来水,但所用电极不同,实验时的现象不同,说明沉淀的产生与电极有关,是通电时,铜电极与溶液中的某些离子发生了反应;
(3)溶液的酸碱度常用pH表示,大于7的溶液显碱性,该水质的pH=7.66,所以水质呈弱碱性;
故答案为:(1)过滤;吸附水中的色素和异味等;
(2)①电能→化学能;②丙;在通电情况下,铜电极与溶液中的某些离子发生了反应;
(3)酸碱;碱.
点评: 本题主要考查学生对水的净化、酸碱度等知识,侧重考查学生应用知识分析、解决问题的能力,要细心分析才能正确解答.












