10.(2分)(2013•眉山)下列说法中,不正确的是( )
A. 化石燃料主要是指煤、石油、天然气
B. 实验室用CaCO3和稀H2SO4反应制取CO2
C. SO2是形成酸雨的主要原因
D. 选择燃料应从资源、经济和环境等多方面综合考滤
考点: 化石燃料及其综合利用;二氧化碳的实验室制法;酸雨的产生、危害及防治.
专题: 化学与环境保护;化学与能源.
分析: A、根据化石燃料的种类分析;
B、根据CaCO3和稀H2SO4反应生成的硫酸钙是微溶的分析;
C、根据形成酸雨的气体的种类分析;
D、根据燃料选择应注意的事项分析 .
.
解答: 解:A、化石燃料主要是指煤、石油、天然气.故A说法正确;
B、由于CaCO3和稀H2SO4反应生成的硫酸钙是微溶的,附着在碳酸钙的表面上阻止了反应的进一步进行,只能收集到少量的二氧化碳气体.不能用作实验室制取二氧化碳.故B说法不正确;
C、形成酸雨的主要气体是SO2及氮的氧化物.故C说法正确;
D、燃料的选择应从资源、经济和环境等多方面综合考虑.故D说法正确.
故选B.
点评: 本题所考查了的都是化学的基础知识,难度不大,应加强基础知识的积累.
11.(2分)(2013•眉山)如图所示,是甲、乙、丙三种固体物质的溶解度曲线.下列说法正确的是( )
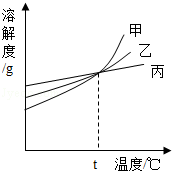
A. t℃时,甲、乙、丙三种物质的饱和溶液的质量分数相等
B. 在两份相同质量的水中分别加入甲与丙,达到饱和时溶解甲的质量大于丙
C. 相同温度时,甲、乙、丙三种饱和溶液,其质量分数关系为:甲>乙>丙
D. 甲中混有少量丙时,可采用高温制成热的饱和溶液,再蒸发结晶提纯甲
考点: 固体溶解度曲线及其作用;结晶的原理、方法及其应用;溶质的质量分数、溶解性和溶解度的关系.
专题: 溶液、浊液与溶解度.
分析: A、某温度时物质的溶解度相等,则饱和溶液中溶质的质量分数相等;
B、要比较溶解物质的质量大小,须确定温度才能比较;
C、要比较饱和溶液中溶质的质量分数大小,须知温度;
D、甲的溶解度受温度影响较大,丙的溶解度受温度影响较小,故提纯甲要用降温结晶的方法.
解答: 解:A、t℃时,甲、乙、丙三种物质的溶解度相等,据饱和溶液中溶质的质量分数的计算式 ×100%,可知三种物质的溶解
×100%,可知三种物质的溶解 度相等则饱和溶液的质量分数相等,正确;
度相等则饱和溶液的质量分数相等,正确;
B、t℃时,甲、丙的溶解度相等,则相同质量的水中分别加入甲与丙,达到饱和时溶解甲的质量等于丙,所以不确定温度,无法比较等量水中最多溶解物质的质量,故描述错误;
C、由A分析可知:t℃时,甲、乙、丙三种物质的饱和溶液中溶质的质量分数才相等,其他温度的饱和溶液中溶质的质量分数不同,故错误;
D、甲的溶解度受温度影响较大,丙的溶解度受温度影响较小,故提纯甲可采用高温制成热的饱和溶液,再降温结晶的方法,故错误;
故选A.
点评: 本题较好考查了溶解度曲线的意义、溶质质量分数的判断的相关知识,掌握对应知识才能正确解答.
12.(2分)(2013•眉山)“低碳生活”倡导我们在生活中所耗用的能量、材料要尽量减少,从而减少二氧化碳排放量.下列做法符合“低碳生活”理 念的是( )
念的是( )
A. 教科书循环使用
B. 使用一次性筷子,减少疾病传染
C. 大量使用私家汽车出行,节约时间
D. 大量建设钢铁冶炼厂,促进经济发展
考点: 自然界中的碳循环.
专题: 化学与环境保护.
分析: 根据题意:“低碳生活”指的是生活作息时所耗用的能量要尽量减少,特别是减少二氧化碳的排放量,减缓生态恶化;可以从节电、节能和回收等环节来改变生活细节,据此进行分析判断即可.
解答: 解:A、教科书循环使用,可以减少森林的砍伐,树木可以通过光合作用吸收二氧化碳,循环使用会减少植物的消耗,故选项符合“低碳生活”理念.
B、使用一次性木筷,增加了森林的砍伐,树木可以通过光合作用吸收更多的二氧化碳,故选项不符合“低碳生活”理念.
C、大量使用私家汽车出行,增加了交通工具的使用,从而增加了二氧化碳的排放,故选项不符合“低碳生活”理念.
D、大量建设钢铁冶炼厂,能产生大量的二氧化碳,增加了二氧化碳的排放,故选项不符合“低碳生活”理念.
故选A.
点评: 低碳生活理念已成为人们的共识,节能减排的措施和观念是化学考查的热点,要用低碳生活理念指导自己的活动,把节能减排的措施运用到生产、生活中去.
13.(2分)(2013•眉山)下图是用回收废料来制取铜,同时制取FeSO4•7H2O的流程图.下列说法中不正确的是( )
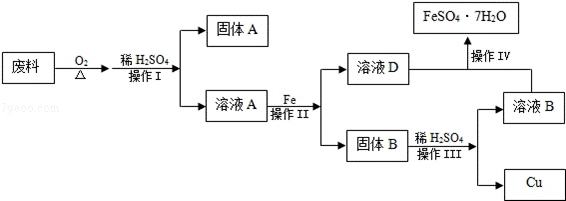
A. 操作Ⅰ、Ⅱ、Ⅲ都是过滤
B. 操作Ⅳ为蒸发结晶
C. 固体B与稀H2SO4反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑.
D. 溶液A与Fe反应的化学方程式为:3CuSO4+2Fe=3Cu+Fe2(SO4)3
考点: 物质的相互转化和制备;过滤的原理、方法及其应用;金属的化学性质.
专题: 物质的制备.
分析: A、过滤可以除去不溶于水的物质;
B、蒸发结晶可以从溶液中获得晶体;
C、铁能和稀硫酸反应,铜不能与稀硫酸反应;
D、铁和硫酸铜反应能生成硫酸亚铁和铜.
解答: 解:A、操作Ⅰ、Ⅱ、Ⅲ都是过滤,操作Ⅰ是通过过滤把硫酸铜溶液和不溶性的杂质分离,操作Ⅱ是通过过滤把硫酸亚铁溶液和铜、过量的铁分离,操作Ⅲ是通过过滤把硫酸亚铁溶液和铜分离.正确.
B、操作Ⅳ为蒸发结晶,通过蒸发可以得到FeSO4•7H2O.正确.
C、固体B中,铜不能和稀硫酸反应,铁能和稀硫酸反应,铁与稀H2SO4反应的化学方程式为:Fe+H2SO4=FeSO4+H2↑.正确.
D、溶液A是硫酸铜溶液,和铁反应的化学方程式为:Fe+CuSO4=Cu+FeSO4.不正确.
故选:D.
点评: 化学实验现象是化学实验最突出、最鲜明的部分,也是进行分析推理得出结论的依据,掌握物质的性质和相互之间的反应关系,并有助于提高观察、实验能力.
14.(2分)(2013•眉山)下列对数据的几种描述中,合理的是( )
A. 用pH试纸测得盐酸pH=3.20 B. 用托盘天平称取NaCl固体5.85g
C. 用10mL量筒量取98%浓H2SO43.68mL D. 用“pH计”测得某血浆pH=7.40
考点: 实验数据处理或者误差分析的探究.
专题: 常见仪器及化学实验基本操作.
分析: A、pH试纸上的标准比色卡上的数字只有整数,即使用pH试纸所测得的溶液酸碱度为整数.
B、托盘天平用于粗略称量药品的质量,能准确到0.1g,不能精确到0.01g.
C、根据10mL量筒的精确度为0.1mL进行分析判断.
D、pH计可以精确到0.1甚至0.01,据此进行分析判断.
解答: 解:A、由于标准比色卡上的数字只有整数,用用pH试纸测得盐酸pH不可能精确为3.20,故选项实验数据不合理.
B、托盘天平用于粗略称量药品的质量,能准确到0.1g,不能精确到0.01g,故不能用托盘天平称取NaCl固体5.85g,故选项实验数据不合理.
C、用10mL量筒量取98%浓H2SO43.68mL,不符合10mL量筒的精确度为0.1mL,故无法量取,故选项实验数据不合理.
D、pH计可以精确到0.1甚至0.01,用“pH计”测得某血浆pH=7.40,故选项实验数据合理.
故选D.
点评: 本题难度不大,考查各种仪器的使用方法及使用注意事项,特别是天平、量筒的使用、酸碱度的测定在中考中出现频度较高,其读数方法和误差的分析更是重中之重.
15.(2分)(2013•眉山)下列各组溶液,只用一种试剂不能鉴别的是( )
A. Na2SO4、CuSO4、NaCl B. NaCl、Na2CO3、Na2SO4
C. FeCl2、NaNO3、Na2SO4 D. (NH4)4SO4、NH4Cl、NaCl
考点: 酸、碱、盐的鉴别.
专题: 压轴实验题;物质的鉴别题.
分析: 根据物质的性质进行分析,只用一种试剂可以鉴别,则需要与物质混合时产生不同的现象,据此解答.
解答: 解:A、使用氢氧化钡溶液,能与氢氧化钡混合产生白色沉淀的是硫酸钠,产生蓝色沉淀的是硫酸铜,无现象的是氯化钠,使用一种试剂可以鉴别;
B、这三种物质的阳离子相同,则反应只能是通过阴离子的反应进行鉴别,因此只使用一种试剂无法鉴别;
C、观察颜色,浅绿色的为氯化亚铁,然后向剩余的两种溶液中加入氢氧化钡溶液,产生沉淀的是硫酸钠,无现象的是硝酸钠,只使用一种试剂可以鉴别;
D、使用氢氧化钡溶液,无现象的是氯化钠,有刺激性气味且产生沉淀的是硫酸铵,只有刺激性气味的是氯化铵,可以鉴别;
故选B.
点评: 本题考查了常见物质的鉴别,完成此题,可以依据物质的性质差异进行.
16.(2分)(2013•眉山)某合金由两种金属元素组成,取该合金60g投入足量稀硫酸中,反应完全后,测得生成H23g,则合金的组成不可能是( )
A. Fe与Zn B. Mg与Cu C. Na与Al D. Al与Fe
考点: 金属的化学性质.
专题: 压轴实验题;金属与金属材料.
分析: 首先判断金属能否与酸反应,然后从金属与酸反应生成氢气的质量关系考虑.根据化学方程式,可得出如下金属与氢气的质量关系:Mg﹣H2:36﹣3 Al﹣H2:27﹣3 Fe﹣H2:84﹣3 Zn﹣H2:97.5﹣3;特殊地,钠的活动性很强,能与水反应放出氢气,所以要生成3g氢气,需要钠的质量为69g,利用平均值法来判断即可得出正确的答案.
解答: 解:根据化学方程式已知金属与氢气的质量关系:Mg﹣H2:36﹣3 Al﹣H2:27﹣3 Fe﹣H2:84﹣3 Zn﹣H2:97.5﹣3 Na﹣H2:69﹣3;利用平均值法得知要生成3克氢气,合金的质量应该符合:金属A的数值<60g<金属B的数值.
A、84和 97.5均大于60,所以合金的组成不可能,故A正确;
B、36小于60,Cu不与酸反应,不产生氢气,所以合金的组成可能,故B错误;
C、27g<60g<69g,所以合金的组成可能,故C错误;
D、27g<60g<84g,所以合金的组成可能,故D错误;
故选A.
点评: 此题要利用平均值法来解决,从金属与酸反应生成氢气的质量关系考虑得出金属与氢气的质量关系,对解决此类题目很有帮助.












