二、填空题(本大题5个小题,共25分)
17.(5分)(2013•眉山)写出下列物质的化学式:
(1)纯碱 Na2CO3 ;
(2)烧碱 NaOH ;
(3)大理石的主要成分 CaCO3 ;
(4)地壳中含量最多的金属元素 Al ;
(5)目前使用量最大的金属 Fe .
考点: 化学式的书写及意义.
专题: 化学用语和质量守恒定律.
分析: 首先根据题意确定物质的化学名称,然后根据书写化学式的方法和步骤写出物质的化学式即可.
解答: 解:(1)纯碱是碳酸钠的俗称,其化学式为:Na2CO3.
(2)烧碱是氢氧化钠的俗称,其化学式为:NaOH.
(3)大理石的主要成分是碳酸钙,其化学式为:CaCO3.
(4)地壳中含量最多的金属元素是铝元素,其元素符号为:Al.
(5)目前使用量最大的金属是铁,其化学式为:Fe.
故答案为:(1)Na2CO3;(2)NaOH;(3)CaCO3;(4)Al;(5)Fe.
点评: 本题难度不大,熟练掌握常见物质的性质、用途、组成及化学式的书写是正确解答此类题的关键所在.
18.(6分)(2013•眉山)根据下列要求填空:
(1)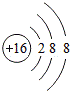 表示的是 S2﹣ (填离子符号),其核电荷数为 16 ;
表示的是 S2﹣ (填离子符号),其核电荷数为 16 ;
(2)质量分数大于1%的盐酸溶液常温下pH < 7(填“>”、“<”、“=”),向盛有盐酸的试管中滴入紫色石蕊试液,溶液变为 红 色;
(3)金属钛又称为21世纪金属,在各个领域都有重要用途.人造卫星和宇宙飞船上的天线是由钛镍形状记忆合金制造的.工业上生产钛是在高温下用熔融TiCl4与钠反应制得.请写出该反应的化学方程式 TiCl4+4Na Ti+4NaCl .
Ti+4NaCl .
考点: 原子结构示意图与离子结构示意图;酸碱指示剂及其性质;溶液的酸碱性与pH值的关系;书写化学方程式、文字表达式、电离方程式.
专题: 化学用语和质量守恒定律;常见的酸 酸的通性.
分析: (1)根据粒子的结构示意图分析;
(2)根据溶液的酸碱性与酸碱度的关系以及指示剂的变色情况分析;
(3)根据工业上制取钛的反应,写出反应的方程式.
解答: 解:(1)由粒子的结构示意图可知,该微粒的质子数是16,核外电子数是18,离子的符号是S2﹣,核电荷数是16;
(2)盐酸的溶液显酸性,pH<7,能使紫色石蕊试液变为红色;
(3)工业上生产钛是在高温下用熔融TiCl4与钠反应制得,该反应的化学方程式是:TiCl4+4Na Ti+4NaCl.
Ti+4NaCl.
故答为:(1)S2﹣,16;(2)<,红; (3)TiCl4+4Na Ti+4NaCl.
Ti+4NaCl.
点评: 本题涉及的知识点较多,但难度不大,属于基础的知识,应加强基础知识的学习.
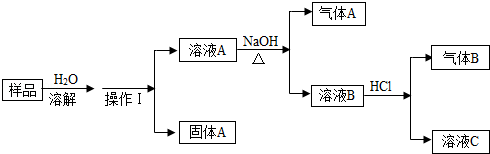
19.(6分)(2013•眉山)有一包白色粉末,可能含有BaCl2、Na2CO3、NH4NO3、NaCl中的部分或全部,为确定其组成,设计如下方案:
请回答下列问题:
(1)操作Ⅰ的名称是 过滤 ,需要使用的玻璃仪器有玻璃棒、烧杯和 漏斗 ;
(2)气体A有刺激性气味,则气体A的化学式为 NH3 ;
(3)气体B为无色无味,则产生该气体的化学方程式为 Na2CO3+2HCl=2NaCl+CO2↑+H2O ;
(4)通过上述实验,还不能确定的物质的化学式 NaCl .
考点: 物质的鉴别、推断;过滤的原理、方法及其应用;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
专题: 混合物组成的推断题.
分析: (1)依据过滤能够分离固体与液体的作用以及过滤操作使用的玻璃仪器分析解答;
(2)依据铵盐遇碱能够生成刺激性气味的氨气分析解答;
(3)依据碳酸盐能与酸反应生成二氧化碳分析解答;
(4)依据(1)~(3)的分析进行判断即可;
解答: 解:(1)操作I是分离固体和液体的操作,所以该操作是过滤,过滤用到的玻璃仪器是漏斗、玻璃棒、烧杯三种仪器;
(2)溶液A加入碱性的氢氧化钠生成气体,则该气体是氨气,溶液A中存在铵盐硝酸铵,氨气具有刺激性气味,化学式为NH3;
(3)溶液B加入盐酸后能生成气体,则说明该气体是二氧化碳,也能同时说明该溶液中含有碳酸钠,反应的方程式为Na2CO3+2HCl=2NaCl+CO2↑+H2O;
(4)原固体加入水后能够生成沉淀,则固体中存在相互反应生成沉淀的物质,所以固体中存在氯化钡,因为氯化钡能与碳酸钠反应生成碳酸钡的白色沉淀,所以通过上述实验,还不能确定的物质是氯化钠(NaCl);
故答案为:(1)过滤;漏斗;(2)NH3;(3)Na2CO3+2HCl=2NaCl+CO2↑+H2O;(4)NaCl;
点评: 解答此类题目往往要从物质的颜色、物质之间相互作用时的实验现象等方面进行分析、判断,从而得出正确的结论.
20.(4分)(2013•眉山)已知98%浓H2SO4密度为1.84g/cm3,62%浓HNO3密度为1.14g/cm3;若要配制浓H2SO4与浓HNO3的混合溶液,则应将 浓H2SO4 (填化学式)沿玻璃棒缓慢倒入盛有 浓HNO3 (填化学式)的烧杯中,边加边搅拌,冷却后装瓶过程中玻璃棒的作用是 引流 、 搅拌 .
考点: 一定溶质质量分数的溶液的配制;浓硫酸的性质及浓硫酸的稀释.
专题: 压轴实验题;溶液、浊液与溶解度.
分析: 根据浓硫酸稀释时放热,所以要配制浓H2SO4与浓HNO3的混合溶液,则应将浓H2SO4沿玻璃棒缓慢倒入盛有浓HNO3的烧杯中,边加边搅拌进行解答.
解答: 解:浓硫酸稀释时放热,所以要配制浓H2SO4与浓HNO3的混合溶液,则应将浓H2SO4沿玻璃棒缓慢倒入盛有浓HNO3的烧杯中,边加边搅拌,冷却后装瓶过程中玻璃棒的作用是引流、搅拌.
故答案为:浓H2SO4;浓HNO3;引流;搅拌.
点评: 本题主要考查了配制溶液的操作步骤,难度不大,注意浓硫酸的稀释.
21.(4分)(2013•眉山)氯碱工业是重要的化学工业,采用电解精制的饱和食盐水来制取NaOH,2NaCl+2H2O 2NaOH+H2↑+Cl2↑.但粗盐中含有杂质Na2SO4、MgCl2、CaCl2、泥沙等,必须经过提纯才能使用.提纯中常用下列操作步骤:①用稍过量的NaOH除去MgCl2;②过滤;③用稍过量的BaCl2除去Na2SO4;④用稍过量的Na2CO3除去CaCl2等;⑤用稍过量的HCl除去NaOH、Na2CO3;则:
2NaOH+H2↑+Cl2↑.但粗盐中含有杂质Na2SO4、MgCl2、CaCl2、泥沙等,必须经过提纯才能使用.提纯中常用下列操作步骤:①用稍过量的NaOH除去MgCl2;②过滤;③用稍过量的BaCl2除去Na2SO4;④用稍过量的Na2CO3除去CaCl2等;⑤用稍过量的HCl除去NaOH、Na2CO3;则:
(1)正确的操作顺序为 ①③④②⑤ 或 ③①④②⑤ (填步骤编号);
(2)加入Na2CO3溶液,其目的之一是除去CaCl2,还的一个目的,其反应的化学方程式为 BaCl2+Na2CO3=BaCO3↓+2NaCl .
考点: 氯化钠与粗盐提纯;盐的化学性质;书写化学方程式、文字表达式、电离方程式.
专题: 压轴实验题;常见的盐 化学肥料.
分析: 根据镁离子用氢氧根离子沉淀,硫酸根离子用钡离子沉淀,钙离子用碳酸根离子沉淀,过滤要放在所有的沉淀操作之后,加碳酸钠要放在加氯化钡之后,可以将过量的钡离子沉淀最后再用盐酸处理溶液中的碳酸根离子和氢氧根离子进行分析.
解答: 解:镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将除去MgCl2;硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将除去Na2SO4;至于先除氯化镁,还是先除硫酸钠都行,钙离子用碳酸根离子沉淀,除氯化钙加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡;离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根 离子,所以正确的顺序为①③④②⑤或③①④②⑤或③④①②⑤.
离子,所以正确的顺序为①③④②⑤或③①④②⑤或③④①②⑤.
(2)加入Na2CO3溶液,其目的之一是除去CaCl2,还有一个目的是除去多余的氯化钡,其反应的化学方程式为BaCl2+Na2CO3=BaCO3↓+2NaCl.
故答案为:(1)①③④②⑤;③①④②⑤;
(2)BaCl2+Na2CO3=BaCO3↓+2NaCl.
点评: 本题主要考查了在粗盐提纯中的物质的除杂或净化操作,在解此类题时,首先要了解需要除去的是哪些离子,然后选择适当的试剂进行除杂,在除杂质时,杂质和所加的试剂的状态一样,就要注意,加入的量的控制.
三、实验探究题(本大题1个小题,共7分)
22.(7分)(2013•眉山)某天化学兴趣小组听老师讲:“浓硫酸加衣服等于洞洞眼眼,还有刺激性气味产生”.兴趣小组结合浓硫酸的性质思考,难道浓硫酸能与碳单质反应?若反应,会生成什么呢?
[查阅资料]:
①SO2能使澄清石灰水变浑浊 Ca(OH)2+SO2=CaSO3+H2O;
②SO2能使品红溶液褪色,用于检验SO2存在;
③SO2能与溴水反应而被吸收 SO2+Br2+2H2O=H2SO4+2HBr.
[提出猜想]:从物质组成元素看,可能生成H2、CO2、CO、SO2气体及H2O;
[实验步骤]:实验小组设计了如下步骤:
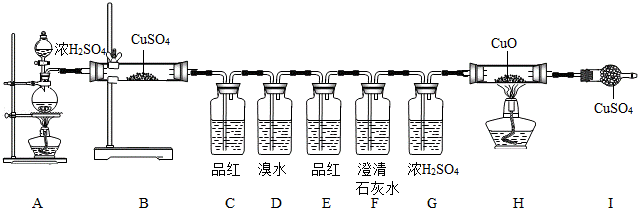
(1)按上述图示安装好仪器;
(2)检查气密性;
(3)加入对应药品,并将浓H2SO4放入烧杯中;
(4)加热A,加热H;
(5)停止加热.
[实验分析]:
(1)B处,固体由白色变蓝色,说明有H2O生成;
(2)C处,品红溶液褪色,说明有 SO2 (填化学式)生成;
(3)E处,品红溶液不褪色,说明 SO2 (填化学式)已被除尽;
(4)F处,澄清石灰水变浑浊,则 产生浑浊的化学方程式为 Ca(OH)2+CO2=CaCO3↓+H2O ;
产生浑浊的化学方程式为 Ca(OH)2+CO2=CaCO3↓+H2O ;
(5)H、I处无现象,说明无CO、H2生成.
[实验结论]:
(1)气体中有H2O和 SO2 CO2 生成,无CO、H2生成;
(2)浓硫酸能与碳单质反应,其化学方程式为 C+ 2H2SO4(浓)
2H2SO4(浓) CO2↑+2SO2↑+2H2O .
CO2↑+2SO2↑+2H2O .
考点: 实验探究物质的性质或变化规律;常见气体的检验与除杂方法;书写化学方程式、文字表达式、电离方程式.
专题: 压轴实验题;科学探究.
分析: [实验分析]:(2)根据SO2能使品红溶液褪色,用于检验SO2存在分析;
(3)根据SO2能与溴水反应而被吸收及SO2能使品红溶液褪色,用于检验SO2存在分析;
(4)根据二氧化碳能够使澄清的石灰水变浑浊分析;
[实验结论]综合分析实验现象得出结论并写出反应的方程式.
解答: 解;[实验分析]:(2)因为SO2能使品红溶液褪色,所以C处品红溶液褪色,说明有二氧化硫生成;
(3)因为SO2能在D装置中与溴水反应而被吸收,所以E处,品红溶液不褪色,说明二氧化硫已经被除尽;
(4)因为二氧化硫已经被除尽,而F处澄清石灰水变浑浊,说明有二氧化碳气体的产生,发生反应的方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
[实验结论](1)综合分析实验现象可以看出产生的气体有H2O和SO2 CO2,无CO、H2生成.
(2)因此浓硫酸和碳反应的方程式为:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O.
CO2↑+2SO2↑+2H2O.
故答案为:[实验分析](2)SO2; (3)SO2; (4)Ca(OH)2+CO2=CaCO3↓+H2O;
[实验结论](1)SO2 CO2;(2)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O.
CO2↑+2SO2↑+2H2O.
点评: 本题属于信息题的考查,难度不大,结合题目提供的有效信息结合已有的相关知识逐步分析 即可解决问题.
即可解决问题.
四、计算题(本大题1个小题,共6分)
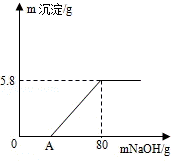
23.(6分)(2013•眉山)向100g稀H2SO4溶液中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入质量分数为20 %的NaOH溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示.请回答:
%的NaOH溶液,所得沉淀质量与加入NaOH溶液质量关系如图所示.请回答:
(1)OA段无沉淀产生,请写出反应的化学方程式 H2SO4+2NaOH=Na2SO4+2H2O ;
(2)加入镁粉的质量为 2.4 g;
(3)求产生氢气的质量是多少g?(写出计算过程,保留小数点后一位).
考点: 根据化学反应方程式的计算.
专题: 压轴实验题;综合计算(图像型、表格型、情景型计算题).
分析: (1)根据开始没有沉淀生成,说明硫酸过量,所以OA段是硫酸和NaOH溶液反应生成硫酸钠和水进行解答;
(2)根据生成沉淀氢氧化镁中镁元素的质量即为加入镁粉的质量进行解答;
(3)根据金属镁的质量求出氢气的质量即可.
解答: 解:(1)开始没有沉淀生成,说明硫酸过量,所以OA段是硫酸和NaOH溶液反应生成硫酸钠和水,反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O;故填:H2SO4+2NaOH=Na2SO4+2H2O;
(2)生成沉淀氢氧化镁中镁元素的质量即为加入镁粉的质量,由图可知生成氢氧化镁的质量为5.8g,所以加入镁粉的质量=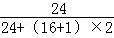 ×100%×5.8g=2.4g;故填:2.4;
×100%×5.8g=2.4g;故填:2.4;
(3)设氢气的质量为x.
H2SO4+Mg=MgSO4+H2↑
24 2
2.4g x
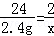
x=0.2g
答:产生氢气的质量是0.2g.
点评: 本题主要考查学生利用化学方程式进行计算的能力.解题的关键是结合物质间反应的情况,正确分析图示数据,细心解答.












