23.(6分)(2013•永州)世界是由物质构成的,物质是由元素构成的.请你依据下表用元素符合填空:
元素名称 | 氢 | 氧 | 碳 | 氮 | 钠 | 铁 |
元素符号 | H | O | C | N | Na | Fe |
(1)目前世界年产量最多的金属是 Fe .
(2)某单质在空气中不完全燃烧时,可产生一种有毒气体,组成该单质的元素是 C .
(3)某可燃物充分燃烧后生成二氧化碳和水,则该可燃物中一定含有的元素是 C、H .
考点: 元素的符号及其意义.
专题: 化学用语和质量守恒定律.
分析: (1)能够区别金属与非金属,记住目前世界上年产量最高的金属是铁;
(2)碳不完全燃烧生成一氧化碳,CO属于一种有毒的气体;
(3)根据质量守恒定律,反应前后元素的种类不变解决此题.
解答: 解:(1)能够区别金属与非金属,记住目前世界上年产量最高的金属是铁,故答案为:Fe;
(2)碳不完全燃烧生成一氧化碳,CO属于一种有毒的气体,故答案为:C;
(3)由题意得知反应物是某可燃物和氧气,生成物是二氧化碳和水,根据质量守恒定律,反应前后元素的种类不变,得知该可燃物中一定含有的元素是碳、氢,故答案为:C、H
点评: 本题属于很基础的题目,重在考查化学用语和质量守恒定律,解题思路很明确,很直接.
24.(6分)(2013•永州)我市九嶷山景区溶洞多,紫霞岩就是其中之一,洞内的钟乳石千姿百态,形成这些溶洞的“主角”是碳酸钙、二氧化碳和水.石灰石中的碳酸钙遇到溶有二氧化碳的水,会生成碳酸氢钙,而溶解在水中的碳酸氢钙,如果受热或大气压强变小,就会转化为碳酸钙、二氧化碳和水,不溶于水的碳酸钙与其它不溶性物质一起沉积下来,经长时间聚积就形成了美丽的钟乳石.试回答:
(1)钟乳石属于 混合物 .(填“混合物”或“纯净物”)
(2)钟乳石的形成过程中碳酸氢钙转化为碳酸钙的化学方程式为 Ca(HCO3)2═CaCO3↓+CO2↑+H2O .该反应属于 分解 反应(填基本反应类型).
考点: 碳酸钠、碳酸氢钠与碳酸钙;纯净物和混合物的判别;反应类型的判定;书写化学方程式、文字表达式、电离方程式.
专题: 常见的盐 化学肥料.
常见的盐 化学肥料.
分析: (1)根据题中所给的钟乳石的形成过程来 进行解答;
进行解答;
(2)根据题中所给信息可以知道碳酸 氢钙能够分解产生碳酸钙、水和二氧化碳,可以据此写出该反应的化学方程式,并根据反应的特点判断反应类型.
氢钙能够分解产生碳酸钙、水和二氧化碳,可以据此写出该反应的化学方程式,并根据反应的特点判断反应类型.
解答: 解:(1)根据题中信息可以知道形成的钟乳石为碳酸钙和其它不溶物的混合物,所以可以判断钟乳石属于混合物;
(2)根据题中所给信息可以知道碳酸氢钙能够分解产生碳酸钙、水和二氧化碳,该反应的化学方程式为:Ca(HCO3)2═CaCO3↓+CO2↑+H2O;该反应中反应物为一种,而生成物为三种,所以属于分解反应.
故答案为:(1)混合物;
(2)Ca(HCO3)2═CaCO3↓+CO2↑+H2O;分解.
点评: 本题主要考查分析和应用信息解答实际问题的能力,要结合物质的性质和反应规律进行综合分析.
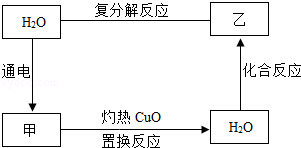
25.(6分)(2013•永州)水是自然界最为重要的物质.下图表示水 与其它常见物质间的一种循环转化关系(部分反应物和生成物未标出),物质甲是单质,物质乙为碱,其相对分子质量为74.
与其它常见物质间的一种循环转化关系(部分反应物和生成物未标出),物质甲是单质,物质乙为碱,其相对分子质量为74.
(1)物质甲、乙的化学式分别为:甲 H2 ,乙 Ca(OH)2 .
(2)物质甲与灼热的CuO反应的化学方程式为 H2+CuO Cu+H2O .
Cu+H2O .
考点: 物质的鉴别、推断;化学式的书写及意义;书写化学方程式、文字表达式、电离方程式.
专题: 框图型推断题;压轴实验题.
分析: 根据已有的知识进行分析,水通电分解生成氢气和氧气,氢气具有还原性,能与灼热的氧化铜反应生成水,故甲是氢气;乙是碱,相对分子质量为74,则乙是氢氧化钙,据此解答 即可.
即可.
解答: 解:水通电分解生成氢气和氧气,氢气具有还原性,能与灼热的氧化铜反应生成水,故甲是氢气;乙是碱,相对分子质量为74,则乙是氢氧化钙,代入框图,推断合理;
(1)甲是氢气,乙是氢氧化钙,故填:H2,Ca(OH)2;
(2)甲是氢气,能与氧化铜在加热的条件下反应生成铜和水,故填:H2+CuO Cu+H2O.
Cu+H2O.
点评 : 本题为框图式物质推断题,完成此题,关键是找准解题突破口,直接得出有关物质的化学式,然后根据物质的性质结合框图推断得出其他物质的化学式.
: 本题为框图式物质推断题,完成此题,关键是找准解题突破口,直接得出有关物质的化学式,然后根据物质的性质结合框图推断得出其他物质的化学式.
26.(4分)(2013•永州)“暖宝宝”已成为寒冬季节中小学生取暖的最爱.“暖宝宝”的主要化学成分为:还原铁粉(Fe)、活性炭(C)、食盐(NaCl)、水(H2O)、氧气(O2)和蛭石,发热原理主要是利用铁氧化反应放出热量来发热.其中涉及的反应方程式有:
①2Fe+O2+2H2O=2Fe(OH)2↓
②4Fe(OH)2+O2+2H2O=xFe(OH)3
③2Fe(OH)3=Fe2O3+3H2O
请问:
(1)上述反应中的x= 4 .
(2)暖宝宝”中铁元素最终以化合物形式存在,其化学式为 Fe2O3 .
考点: 化学方程式的配平;物质的相互转化和制备;化学式的书写及意义.
专题: 压轴实验题;化学用语和质量守恒定律.
分析: (1)根据质量守恒定律中化学反应前后原子的种类和个数都不变分析;
(2)根据反应原理中铁最终的产物分析.
解答: 解:(1)在4Fe(OH)2+O2+2H2O=xFe(OH)3中反应前铁、氧、氢的原子个数分别为4、12、12,反应后铁、氧、氢原子的个数分别为1、3、3,因此Fe(OH)3的化学计量数是4;
(2)根据三个反应原理,铁最终转化为氧化铁,化学式为Fe2O3;
故答案为:(1)4;(2)Fe2O3.
点评: 本题考查了质量守恒定律的运用及根据信息解决问题的知识,难度不大,能够考查学生的知识运用能力和阅读信息的能力.
三、解答题(共3小题,满分24分)
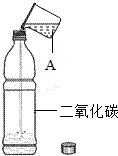
27.(6分)(2013•永州)下图是教材中“二氧化碳的溶解性实验”﹣﹣向一个收集满二氧化碳气体的质地较软的塑料瓶中加入约体积的水,立即旋紧瓶盖,观察塑料瓶的变化.请问:
(1)指出仪器A的名称 烧杯 .
(2)实验操作中,旋紧瓶盖后,还需进行的操作是 振荡 .
(3)最后可观察到的实验现象是 塑料瓶变瘪 .
由此得出的结论是:二氧化碳能溶于水.
考点: 二氧化碳的物理性质.
专题: 碳单质与含碳化合物的性质与用途.
分析: (1)熟悉常见实验仪器的名称;
(2)旋紧瓶盖后,振荡使之充分接触;
(3)根据压强的原理,由于瓶内气体的减少,造成了瓶内的压强减小.
解答: 解:(1)熟悉常见实验仪器的名称,故答案为:烧杯;
(2)旋紧瓶盖后,振荡使之充分接触,故答案为:振荡;
(3)根据压强的原理,由于瓶内气体的减少,造成了瓶内的压强减小,所以最后可观察到的实验现象是塑料瓶变瘪,故答案为:塑料瓶变瘪.
点评: 此实验在教学中是很重要的实验,所以同学们做对此题并不难.
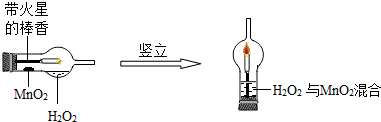
28.(8分)(2013•永州)实验创新是中学生最为重要的科学素养.下图是某学校师生对“MnO2催化H2O2分解实验装置的创新设计”,实验过程如下:
①将一支球形干燥管水平放置,用滴管吸取3ml(密度为lg/ml)质量分数为5%的H2O2加入干燥管的球泡内,再用药匙取0.2gMnO2粉末,加在干燥的进气管的管壁上.
②点燃橡胶塞上固定的棒香后,塞紧干燥管并将其竖立,观察现象.
请分析回答:(1)可观察带到火星的棒香立即 复燃 .
(2)写出上述实验中H2O2分解的化学反应方程式 2H2O2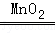 2H2O+O2↑ .
2H2O+O2↑ .
(3)假定上述实验中的H2O2完全反应,可产生氧气的质量为 0.07 g.(精确到0.01)
(4)下列各项是同学们对该创新实验的评价,你认为评价不合理的是 BC .(填序号)
A、实验中所用的仪器、材料及药品均易得到
B、实验使用的药品用量太大
C、反应速度太慢,耽误时间
D、实验现象明显,整个装置好似点燃的灯塔,趣味性强
考点: 催化剂的特点与催化作用;氧气的检验和验满;书写化学方程式、文字表达式、电离方程式.
专题: 压轴实验题;科学探究.
分析: (1)过氧化氢溶液在二氧化锰的催化作用下能快速放出氧气,因为氧气具有支持燃烧的性质,所以能使带到火星的棒香立即复燃;
(2)注意书写化学方程的步骤,明确反应物、生成物、反应条件;
(3)根据化学方程式计算的步骤,由过氧化氢的质量去求算产生氧气的质量;
(4)评价要实事求是,不能随便乱说,实验使用的药品用量不算大;反应速度不慢.
解答: 解:(1)过氧化氢溶液在二氧化锰的催化作用下能快速放出氧气,因为氧气具有支持燃烧的性质,所以能使带到火星的棒香立即复燃,故答案为:复燃;
(2)注意书写化学方程式的步骤,明确反应物、生成物、反应条件,故答案为:2H2O2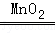 2H2O+O2↑
2H2O+O2↑
2H2O2H2O+O2↑;
(3)根据化学方程式计算的步骤,由过氧化氢的质量去求算产生氧气的质量,
解:设H2O2完全反应,可产生氧气的质量为x,
H2O2的质量为:3ml×lg/ml×5%=0.15g
2H2O2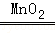 2H2O+O2↑
2H2O+O2↑
68 32
0.15g x
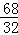 =
=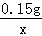
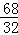
解得:x=0.07g
故答案为:0.07
(4)评价要实事求是,不能随便乱说,实验使用的药品用量不算大;反应速度不慢,故答案为:BC
点评: 此题设计新颖,把对根据化学方程式的计算技能的考查和对信息阅读能力的考查有机地结合了起来,突出了新课改的理念.
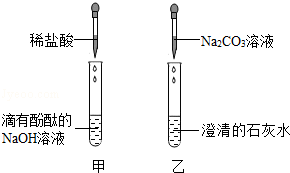
29.(10分)(2013•永州)某化学研究性学习小组在学习碱的化学性质时,设计了实验方案,进行了如图所示的实验,并查阅资料得知:Na2CO3溶液和澄清的石灰水都呈碱性(pH>7),CaCl2溶液呈中性(pH=7).
(1)甲实验中,滴有酚酞的氢氧化钠溶液呈 红 色,逐滴加入稀盐酸,直至溶液恰好呈无色为止.
(2)乙实验试管内产生白色沉淀,其发生反应的化学方程式为 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH .
(3)实验结束后,同学们将甲、乙两个实验的废液倒入同一个烧杯中,观察到废液呈浑浊并显红色,由此分析可知:
①废液中除碳酸钙、氯化钠、水和指示剂外,一定还含有 氢氧化钠 .
②依据上述实验过程,你认为引起废液呈碱性的物质组成共有 3 种可能.
(4)如果将乙实验中的澄清石灰水改为CaCl2溶液,同样进行实验(1)(2)(3)的操作,废液呈浑浊并显红色的现象 可能 (填“可能”或“不可能”)出现.
考点: 碱的化学性质;碳酸钠、碳酸氢钠与碳酸钙;书写化学方程式、文字表达式、电离方程式.
专题: 压轴实验题;常见的碱 碱的通性.
分析: 根据已有的知识进行分析,酚酞试液在碱性溶液中为红色;氢氧化钙能与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,碳酸钠和氢氧化钙反应时可能是恰好完全反应,也可能是物质有剩余;氯化钙能与碳酸钠反应生成氯化钠和碳酸钙,同样存在物质过量的情况,据此解答.
解答: 解:(1)氢氧化钠溶液呈碱性,能使酚酞试液变红,故填:红;
(2)碳酸钠能与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,故填:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(3)①酚酞试液在碱性溶液中为红色,由于碳酸钠与氢氧化钙反应生成氢氧化钠,故一定含有氢氧化钠,故填:氢氧化钠;
②若碳酸钠与氢氧化钙恰好完全反应,则可以是碳酸钙、氯化钠、水和指示剂以及氢氧化钠;若碳酸钠有剩余,则可以是碳酸钙、氯化钠、水、指示剂、氢氧化钠和碳酸钠;若是氢氧化钙有剩余,则可以是碳酸钙、氯化钠、水指示剂、氢氧化钠和氢氧化钙,故有三种物质组合,故填:3;
(4)改成氯化钙溶液,若碳酸钠有剩余,由于碳酸钠溶液呈碱性,同样可能会出现溶液变浑浊的现象,故填:可能.
点评: 本题考查了常见物质间的反应以及物质反应时过量问题的探究,完成此题,可以依据题干提供的信息结合物质的性质进行.
四、计算题(共1小题,满分6分)
30.(6分)(2013•永州)过氧化钠(Na2O2)是一种重要的氧化剂,它与水反应产生氧气的化学方程式为2Na2O2+2H2O=4NaOH+O2↑.现将一定量的Na2O2加入盛有87.6g水的烧杯中,完全反应后,称得溶液的质量比反应前过氧化钠和水的总质量减少了3.2g(假定水蒸气的挥发忽略不计).请回答:
(1)反应生成氧气的质量为 3.2 g.
(2)假定上述Na2O2中含氧的质量为m1,反应生成的NaOH中含氧的质量为m2,则m1 = m2(填“=”“>”或“<”).
(3)计算反应后所得溶液中溶质的质量分数.(写出详细的计算过程)
考点: 根据化学反应方程式的计算;有关溶质质量分数的简单计算.
专题: 压轴实验题;溶质质量分数与化学方程式相结合的计算.
分析: (1)根据质量守恒定律可以知道反应前后减少的质量即为氧气的质量;
(2)根据2Na2O2+2H2O=4NaOH+O2↑可知Na2O2中含氧的质量与反应生成的NaOH中含氧的质量相等进行解答;
(3)根据反应的化学方程式可以知道反应后的溶液为氢氧化钠溶液,可以根据氧气的质量结合化学方程式求算出氢氧化钠的质量,进而求算出氢氧化钠溶液的质量分数.
解答: 解:(1)根据质量守恒定律可以知道反应前后减少的质量即为氧气的质量,即生成氧气的质量为3.2g;故填:3.2;
(2)根据2Na2O2+2H2O=4NaOH+O2↑可知Na2O2中含氧的质量与反应生成的NaOH中含氧的质量相等;故填:=;
(3)设参加反应的过氧化钠的质量为x,生成氢氧化钠的质量为y
2Na2O2+2H2O═4NaOH+O2↑
156 160 32
x y 3.2g
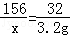
x=15.6g
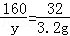
y=16g
反应后所得溶液中溶质的质量分数=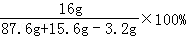 =16%
=16%
答:反应后所得溶液中溶质的质量分数16%.
点评: 要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等.然后,根据所给的问题情景,结合所学的相关知识和技能,细致地分析题意并细心地探究、推理后,按照题目要求进行认真地解答即可.












